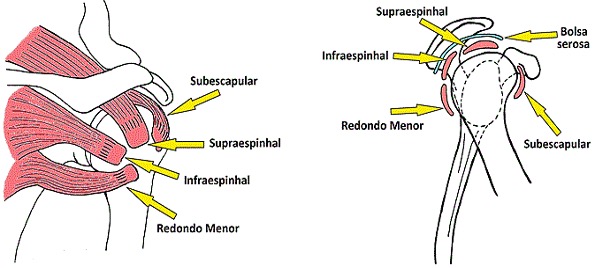
A Tendinite Calcária (TC) ou calcárea do ombro é um distúrbio doloroso comum, caracterizado por depósitos de cristais de hidroxiapatita de cálcio na inserção dos tendões do manguito rotador (responsável pela rotação dos ombros) e nos tecidos sinoviais, incluindo a bolsa subacromial, afetando principalmente o tendão supraespinhal, mas ocasionalmente é observado no infraespinhal e subescapular.
Na TC, dores relacionadas as atividades repetitivas, edema local, presença de sensibilidade e graus variáveis de comprometimento são os aspectos clínicos usuais. Apesar da condição se resolver espontaneamente, um número significativo de pacientes permanece sintomático, sem evidências radiográficas de melhora. Nesses casos, o processo natural de deposição calcificada dentro dos tendões, seguido pela reabsorção dos depósitos, é de alguma forma interrompido.
Características epidemiológicas
Em relação a epidemiologia, a prevalência da tendinite calcária em adultos varia entre 2,7% e 10,3%; 3 em cada 6 (50%) desses pacientes acabam se tornando sintomáticos. A condição é mais comum em mulheres, que são duas vezes mais afetadas que os homens e é comumente apresentado em pacientes com idades entre 30 e 60 anos, sendo bilateral em 10% a 25% dos indivíduos.
Em relação à localização das calcificações, a maioria dos estudos relatam que o tendão supraespinhal é o mais afetado com uma incidência de 51,5% a 90% dos casos. Além disso, estudos relatam que a distribuição de depósitos calcificados multifocais apresenta uma prevalência de 28,2% em comparação com os 8% relatados anteriormente. De acordo com a literatura, os dados mostram que todas as calcificações eram insercionais, situadas na chamada “zona crítica” resultante de sua pobre vascularização.
Etiologia da tendinite calcaria do ombro
Ainda é discutido dentro da comunidade médica a origem da tendinite calcária. Várias hipóteses para o processo patológico foram sugeridas, sendo elas, degenerativo, traumas repetitivos, necrose de tenócitos, reativos e ossificação endocondral; no entanto, nenhuma dessas explicações mostrou-se inteiramente satisfatória.
Dados de estudos recentes usando células-tronco tendíneas (CTTs) alojadas em espaços específicos chamados “nichos” de humanos, coelhos, camundongos e ratos apontaram novas evidências sobre os mecanismos que poderiam estar envolvidos na doença. Esses estudos mostraram que o nicho de CTT é composto predominantemente de matriz extracelular (MEC) e que biglycan (proteoglicano de repetição rico em leucina e que pode estar ligado ao papel de mineralização óssea) e fibromodulina são críticos na organização dessa estrutura.
Em condições normais e após o trauma, os CTTs podem se diferenciar em tenócitos e se autorrenovar, desempenhando um papel importante no reparo e manutenção de tendões. Entretanto, na presença de condições locais alteradas, os CTTs podem se diferenciar em condrócitos ou osteoblastos em vez de tenócitos, provavelmente por meio de um mecanismo mediado pela E2 da prostaglandina. A atividade desses não tenócitos resulta em condrometaplasia e ossificação, criando assim uma MEC aberrante e provocando a formação de depósitos calcificados na estrutura do tendão.
Além disso, foi demonstrada uma associação entre tendinite calcaria do ombro e diabetes; mais de 30% dos pacientes com diabetes insulino-dependentes apresentaram calcificações nos tendões. Foi proposto que a exposição a altos níveis de glicose pode precipitar a glicosilação de várias proteínas da matriz. Conclui-se que essas alterações no MEC podem ter impacto na estrutura e no funcionamento dos nichos de CTT.
Outro ponto importante, é a influência da genética; um estudo em modelo murino evidenciou que camundongos com a mutação “ANK” (ANK significa lócus de anquilose progressiva) sofrem uma forma progressiva generalizada de artrite acompanhada de deposição mineral, formação de osteófitos e degeneração articular, imitando a artrite humana causada pela doença de deposição de apatita.
O gene ANK codifica uma proteína transmembranar essencial para o transporte de pirofosfato inorgânico (PPi) para fora das células. O PPi é um grande inibidor de calcificações. A mutação do gene ANK causa uma diminuição acentuada no PPi extracelular, produzindo um ambiente favorável à deposição de cristais, e a proteína ANK humana no cromossomo 5p é quase idêntica à proteína ANK murina.
Característica clínica e classificação
Muitas classificações foram sugeridas para descrever a tendinite calcária. Alguns a classificaram de acordo com a gravidade dos sintomas em aguda, subaguda e crônica. Outros o classificaram de acordo com a forma radiológica em duas categorias. O primeiro com depósitos localizados, discretos, densos e homogêneos com tendência espontânea à cicatrização e o segundo com depósitos difusos, macios e heterogêneos, caracterizados por cicatrização retardada e lenta.
A sociedade francesa de artroscopia dividiu a condição em quatro tipos: Tipo A (20%) com depósitos homogêneos com bordas bem definidas; Tipo B (45%) com depósitos fragmentados heterogêneos com bordas bem definidas; Tipo C (30%) com depósitos heterogêneos com bordas mal definidas e Tipo D que não é tendinite calcificada, mas calcificações distróficas degenerativas na inserção do manguito rotador .
Uhthoff e colaboradores foram os que descreveram o ciclo completo dos depósitos de cálcio e explicaram o desenvolvimento de sua história natural. Eles dividiram a condição em fases formativa e reabsortiva. Nas duas fases, a maioria dos autores apontou a presença de três etapas; pré-calcificação (silenciosa), calcificação (impacto) e pós-calcificação (aguda).
A fase formativa crônica resulta da hipóxia transitória que é comumente associada ao microtrauma repetido e, às vezes, a um único trauma significativo. Isso resulta em níveis aumentados de proteoglicano que induzem metaplasia de tenócitos em condrócitos. Isto é seguido por depósitos de cálcio, principalmente nas vesículas da matriz dentro dos condrócitos. Esses depósitos se desenvolvem em focos ósseos que depois se fundem.
Durante a fase reabsortiva aguda, a periferia dos depósitos de cálcio mostra vascularização com macrófagos e infiltração de células gigantes mononucleares juntamente com a formação de fibroblastos. Isso produz uma reação inflamatória agressiva com acúmulo de células inflamatórias, edema excessivo e aumento da pressão intra-tendínea. Isso leva a uma dor intensa que é atribuída por alguns ao impacto secundário resultante do aumento do tamanho do tendão ou devido à ruptura dos depósitos no espaço subacromial ou na bolsa.
Durante o estágio pós-calcificação, os fibroblastos depositam colágeno (principalmente tipo II) que preenche a lacuna. Isso amadurecerá em colágeno tipo I dentro de 12 a 16 meses.
A apresentação clínica é altamente variável e depende da fase pela qual o paciente está passando. Durante a fase formativa crônica que pode se estender de 1 a 6 anos, o paciente pode ser completamente assintomático. Em alguns casos, a condição só será descoberta acidentalmente. Alguns pacientes podem apresentar sintomas que imitam impacto leve. No entanto, durante a fase reabsortiva aguda, o paciente geralmente apresenta sintomas graves que podem se estender de 3 semanas a 6 meses.
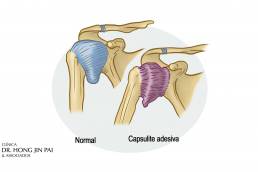
De um modo geral, quanto mais graves os sintomas, menor a duração da condição. O paciente apresenta uma dor tremenda em todo o ombro e sensibilidade sobre a inserção supraespinhal. A dor geralmente se estende à raiz do pescoço com dificuldade durante a atividade aérea associada ao espasmo muscular. Os sintomas também podem estar associados a espasmos musculares, inflamação da bursa subacromial (bursite), patologia da cabeça longa do bíceps, capsulite adesiva secundária.
Diagnóstico
Investigações radiológicas confirmam o diagnóstico e também sugere a fase da condição e é usado para acompanhar sua progressão. Eles incluem raios-X convencionais nas verdadeiras vistas anteroposterior, lateral e de saída. Depósitos dentro do subescapular podem ser detectados pela visão anteroposterior em rotação externa. Na rotação interna, os depósitos dentro do infraespinal e redondo menor podem ser detectados. “Aparência da calota craniana” indica ruptura dos depósitos dentro da bolsa. Foi relatado que o exame ultrassonográfico era mais sensível na detecção dos depósitos de cálcio no manguito.
A tomografia computadorizada permitiu melhor localização dos depósitos. Embora as radiografias convencionais de rotina permitissem a detecção dos depósitos, os estudos de ressonância magnética (RM) permitem uma melhor avaliação de qualquer patologia coexistente. Os depósitos apresentam um sinal de baixa intensidade nas imagens ponderadas em T1. Nas imagens ponderadas em T2, pode haver sinal perifocal de baixa intensidade, indicando edema circundante.
O manguito diluído lateralmente aos depósitos pode ser falsamente interpretado como uma ruptura do manguito. A artrografia por ressonância magnética é mais benéfica para evitar conclusões falsas.
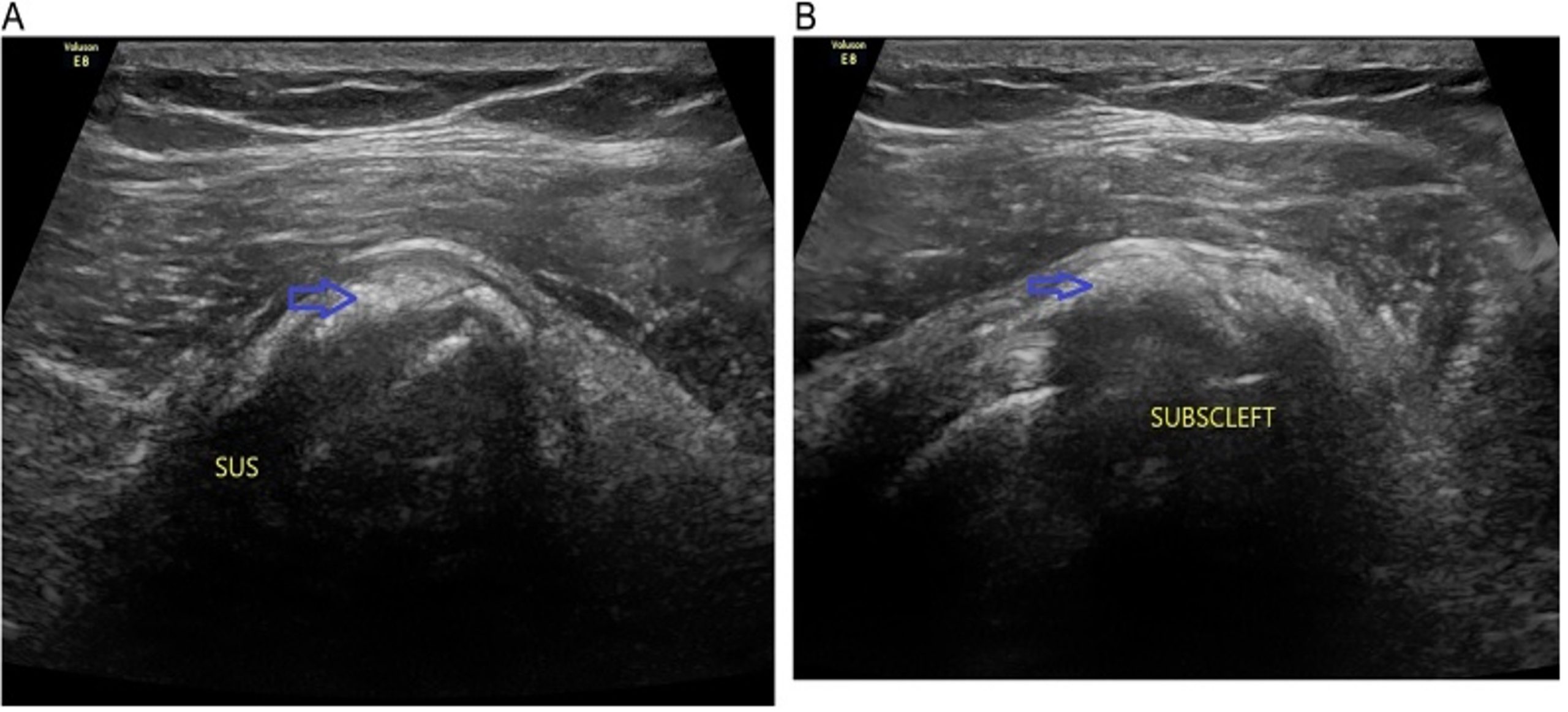
Imagens ultrassonográficas de depósitos de calcificação no tendão (A) supraespinhal (B) subescapular. Fonte: UMAMAHESVARAN, 2018.
Tratamento da tendinite calcaria do ombro
O tratamento da tendinite calcaria do ombro inclui o uso de AINEs, frequentemente úteis para aliviar a dor nas fases agudas da patologia, fisioterapia apropriada para evitar rigidez articular, injeções locais de esteróides e modalidades de tratamento mais recentes, como terapia por ondas de choque extracorpóreas (ESWT) e US agulhas guiadas (UGN), bem como a terapia com plasma rico em plaquetas (PRP) que apesar de promissores há necessidade de mais estudos.
A remoção cirúrgica dos depósitos de cálcio, abertos ou artroscópicos, é geralmente considerada após a falha do tratamento conservador. Contudo, à luz dos últimos avanços, mesmo que não conclusivos, sobre a origem e os mecanismos da doença, uma abordagem terapêutica mais consciente e responsiva pode ser aconselhável.
Conclusões
Evidencias científicas revelam diversas teorias sobre o mecanismo fisiopatológico que pode ajudar a elucidar melhor a TC. Além disso, há bons estudos de opções terapêuticas em andamento que mostram – se promissores visto que não há um tratamento padrão-ouro para a doença.
REFERÊNCIAS
BI, Y. et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche. Nat Med. 2007;13(10):1219–1227.
EA, H. K. et al. Diagnosis and clinical manifestations of calcium pyro-phosphate and basic calcium phosphate crystal deposition diseases. Rheum Dis Clin North Am. 2014;40(2):207–229.
MALDONADO I. et al. Familial calcium crystal diseases: what have we learned? Curr Opin Rheumatol. 2001;13(3):225–233.
PEACH C. A. et al. Cuff tear arthropathy: evidence of functional variation in pyrophosphate metabolism genes. Clin Orthop Relat Res. 2007;462:67–72.
ROSENTHAL A. K. et al. Advanced glycation end products increase transglutaminase activity in primary porcine tenocytes. J Investig Med. 2009;57(2):460–466.
SANSONE V.C. et al. Are occupational repetitive movements of the upper arm associated with rotator cuff calcific tendinopathies? Rheumatol Int 2015;35:273-80.
SANSONE V. et al. Calcific tendinopathy of the rotator cuff: the correlation between pain and imaging features in symptomatic and asymptomatic female shoulders. Skeletal Radiol. 2016;45(1):49–55.
UHTHOFF, H. K. et al. Calcific tendinopathy of the rotator cuff: pathogenesis, diagnosis, and management. J Am Acad Orthop Surg. 1997;5(4):183–191.
UMAMAHESVARAN, B. et al. Calcifying Tendinitis of Shoulder: A Concise Review. Journal of Orthopaedics, 2018;15(3), 776–782.
Dr. Marcus Yu Bin Pai
CRM-SP: 158074 / RQE: 65523 - 65524 |
Médico especialista em Fisiatria e Acupuntura. Área de Atuação em Dor pela AMB. Doutorado em Ciências pela USP. Pesquisador e Colaborador do Grupo de Dor do Departamento de Neurologia do HC-FMUSP. Diretor de Marketing do Colégio Médico de Acupuntura do Estado de São Paulo (CMAeSP).
Integrante da Câmara Técnica de Acupuntura do Conselho Regional de Medicina do Estado de São Paulo (CREMESP). Secretário do Comitê de Acupuntura da Sociedade Brasileira para Estudo da Dor (SBED). Presidente do Comitê de Acupuntura da Sociedade Brasileira de Regeneração Tecidual (SBRET).
Professor convidado do Curso de Pós-Graduação em Dor da Universidade de São Paulo (USP). Membro do Conselho Revisor - Medicina Física e Reabilitação da Journal of the Brazilian Medical Association (AMB).